Bei seinen Untersuchungen zu Gärungsprozessen im Flußschlamm entdeckte der deutsche Biochemiker Hoppe-Seyler Ende des 19. Jahrhunderts erstmals, daß Bakterien molekularen Wasserstoff aufnehmen und abgeben. Seitdem wurde der Wasserstoffmetabolismus bei Mikroorganismen eingehender untersucht. Im Jahre 1931 wurde der Name "Hydrogenase" für das an diesen Prozessen beteiligte Enzym geprägt und in den darauffolgenden Jahren in einer Reihe von Bakterien, Algen, Trichomonaden und Ciliaten nachgewiesen. Auch bei einigen, Pilzen, Moosen und höheren Pflanzen konnte Hydrogenaseaktivität gemessen werden, jedoch sind diese Ergebnisse wegen der möglichen Kontaminierung mit Bakterien umstritten.
Das Enzym Hydrogenase katalysiert sowohl die oxidative Spaltung von molekularem Wasserstoff zu Protonen und Elektronen als auch die reduktive Bildung von Wasserstoff aus Protonen:
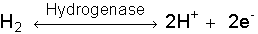
In vivo katalysieren Hydrogenasen meist nur eine Richtung der Reaktion. Obwohl Hydrogenasen die chemisch denkbar einfachste reversible Oxidation von Wasserstoff zu Protonen katalysieren, handelt es sich bei ihnen um eine eher heterogene Klasse von Enzymen, die sich hinsichtlich ihrer molekularen Massen, Zusammensetzung ihrer Untereinheiten, Spezifität gegenüber unterschiedlichen physiologischen Elektronendonatoren und -akzeptoren, Metallgehalt, Cofaktoren, spezifischen Aktivitäten und Empfindlichkeit gegenüber molekularem Sauerstoff erheblich unterscheiden. Gemeinsam haben die Hydrogenasen jedoch, daß es sich bei ihnen um [Fe-S]-Proteine handelt. Eine Ausnahme stellt die wasserstoffbildende Methylentetrahydromethanopterin-Dehydrogenase in methanogenen Archaebakterien dar, die kein Metall enthält.
Eine Vielzahl verschiedener Hydrogenasen sind bislang von prokaryontischen Mikroorganismen näher charakterisiert worden, dagegen bislang nur 5 Hydrogenasen eukaryontischer Organismen.
Die Hydrogenasen prokaryontischer Organismen sind seit vielen Jahren Gegenstand der Forschung. Sie sind hinsichtlich ihrer katalytischen Eigenschaften und ihrer Struktur z.T. gut charakterisiert. Im folgenden sind die bekannten Hydrogenasen nach dem Metallgehalt in ihrem aktiven Zentrum gegliedert.