Schlüsselenzyme
Wie alle wichtigen Stoffwechselleistungen in der Biologie, so wird auch der Umsatz von Wasserstoff von speziellen Enzymen katalysiert. Die wichtigste Enzymklasse in dieser Hinsicht bilden die Hydrogenasen. Eine andere Enzymklasse, die der Nitrogenasen, bildet Wasserstoffgas nur als ein Nebenprodukt ihrer katalytischen Aktivität, der Reduktion von Stickstoff zu Ammonionionen. Zudem kommen sie nur bei stickstoffixierenden Bakterien, nicht jedoch bei Algen vor. In der Tabelle 1 sind Gemeinsamkeiten und Unterschiede der Hydrogenasen und Nitrogenasen gegenübergestellt.
Tab. 1: Vergleich von Hydrogenasen und Nitrogenasen.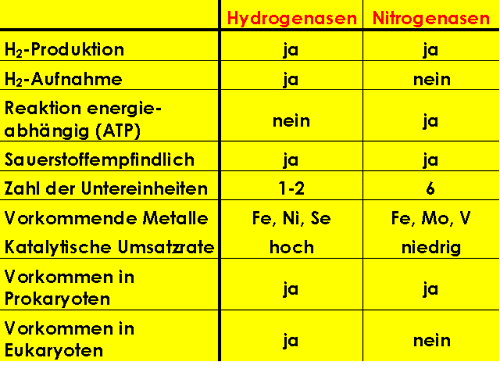
Hydrogenasen
Hydrogenasen katalysieren sowohl die Reduktion von Protonen zu Wasserstoff als auch die Umkehrreaktion: 2H+ + 2e- <-> H2. Diese Enzyme sind in den meisten Fällen sehr sauerstoffempfindlich. Oft reicht schon ein kurzer Kontakt mit der Luft aus, um sie zu inaktivieren. Wie weiter unten noch gezeigt wird, ist diese Sauerstoffempfindlichkeit das Kernproblem, das der biologischen Wasserstofferzeugung im technischen Maßstab im Wege steht. Daher wird zur Zeit unter größten Anstrengungen versucht, den Reaktionsmechanismus und die Struktur des wasserstoffumsetzenden aktiven Zentrums aufzuklären. Man erhofft sich daraus, das Prinzip der Sauerstoffhemmung zu verstehen. Zur näheren Charakterisierung im aktiven Zustand werden auf Grund der Sauerstoffempfindlichkeit bei den meisten Hydrogenasen deren Isolierung und alle anschließenden Untersuchungen unter Ausschluß von Sauerstoff durchgeführt, eine aufwendige und damit langwierige Vorgehensweise. Um Aussagen über den Aufbau und den Reaktionsmechanismus treffen zu können, schließen sich an die Enzymisolierung vielfältige biochemische und biophysikalische Untersuchungen an. Für die Charakterisierung der Metalle des aktiven Zentrums werden vor allem ESR- (Elektronen-Spin-Resonanz), AA- (Atom-Absorptions), Mössbauer- und neuerdings FTIR- (Fourier-Transformations-Infrarot) spektroskopische Methoden angewendet.
Die Vielfalt der Hydrogenasen
Besonders die Hydrogenasen aus Bakterien sind hinsichtlich ihrer katalytischen Eigenschaften und molekularen Struktur schon weitgehend untersucht. Auf Grund des Vorkommens verschiedener Metalle im aktiven Zentrum werden zur Zeit vier Hydrogenasetypen unterschieden: Eisen- (Fe-), Nickel-Eisen- (NiFe-), Nickel- Eisen-Selen- (NiFeSe-) und metallfreie Hydrogenasen. Bei Algen sind bislang nur Fe- und NiFe-Hydrogenasen nachgewiesen worden. Fe-Hydrogenasen zeigen die größte Sauerstoffempfindlichkeit, aber zugleich auch die höchsten Umsatzraten. Ihr aktives Zentrum wird als H-Cluster (H=hydrogen activating) bezeichnet und enthält wahrscheinlich sechs Eisenatome. Weder die detailierte Struktur des aktiven Zentrums, noch der Reaktionsmechanismus der Fe-Hydrogenasen sind bislang verstanden. Bei NiFe-Hydrogenasen kommt neben Eisen auch Nickel im aktiven Zentrum vor. Wegen ihrer etwas geringeren Empfindlichkeit gegenüber Sauerstoff und ihrer großen Verbreitung im Bakterienreich sind sie die zur Zeit am besten untersuchten Hydrogenasen.
Die Kristallstruktur einer NiFe-Hydrogenase
NiFe-Hydrogenasen bestehen aus mindestens zwei verschiedenen Protein-Untereinheiten. Die größere Untereinheit enthält das aktive Zentrum, während die kleinere Untereinheit [FeS]-Cluster für den Elektronentransfer trägt. Ein Meilenstein in der Hydrogenaseforschung war die erst kürzlich erfolgte Aufklärung der Röntgen-Kristallstruktur einer NiFe-Hydrogenase aus dem Bakterium Desulfovibrio gigas. Die Verknüpfung spektroskopischer Daten mit der Kristallstruktur ergibt ein schon sehr detailiertes Bild vom Aufbau dieser NiFe-Hydrogenase (Abbildung 1).
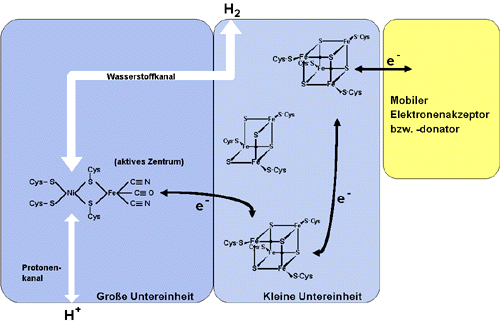
Abb. 1: Schematischer Aufbau einer NiFe-Hydrogenase am Beispiel der durch Röntgenstrukturanalyse untersuchten Hydrogenase aus Desulfovibro gigas. Mit e- gekennzeichnete Pfeile deuten Elektronentransfer an.
Das in der großen Untereinheit liegende aktive Zentrum besteht danach aus einem Ni- und einem Fe-Atom. Beide Atome sind über Sulfhydrylguppen (-SH) der Aminosäure Cystein (Cys) an die Proteinmatrix gebunden. An das Fe-Atom sind zusätzlich zwei Cyanid- (CN-) und ein Kohlenmonoxidmolekül (CO) koordiniert, zwei äußerst ungewöhnliche Liganden in der Biologie. Die Kristallstruktur läßt vermuten, daß sich das Wasserstoffmolekül als Substrat an das NiFe-Zentrum anlagert und dann gespalten wird. Der genaue Reaktionsmechanismus ist jedoch noch unklar und wird zur Zeit heftig diskutiert. Die kleine Untereinheit dieser NiFe-Hydrogenase bindet zwei [4Fe-4S]-Cluster, die den Elektronentransfer zwischen dem aktiven Zentrum und einem mobilen Elektronentransportprotein (zum Beispiel einem Cytochrom) bewerkstelligen. Ein ebenfalls vorhandener [3Fe-4S]-Cluster scheint am Elektronentransfer nicht direkt beteiligt zu sein. Darüber hinaus konnten kanalartig verbundene Zwischenräume in den Proteinkomponenten nachgewiesen werden. In diesen können Wasserstoff und Protonen von der Enzymoberfläche zum aktiven Zentrum und umgekehrt gelangen.



